Afatinib cải thiện kết cục lâm sàng trên bệnh nhân ung thư phổi không tế bào nhỏ, đột biến EGFR dương tính:
Kết quả từ thử nghiệm lâm sàng ngẫu nhiên, có nhóm chứng so sánh với gefitinib (LUX-Lung 7)

Điều trị bước một ung thư phổi không tế bào nhỏ (UTPKTBN) có đột biến EGFR(+) đã được chấp thuận với các thuốc ức chế tyrosine kinase (TKI) nhắm đích phân tử EGFR, bao gồm gefitinib, erlotinib và afatinib1-3.Tất cả 3 loại thuốc này đều đã chứng minh được hiệu quả và thời gian sống còn qua các thử nghiệm lâm sàng, cho thấy cải thiện về thời gian sống không bệnh tiến triển (PFS), đáp ứng khách quan, và hơn nữa, có hồ sơ an toàn chấp nhận được, so với hóa trị bước một bộ đôi platinum4-11.
Tuy nhiên, cơ chế tác động của các thuốc EGFR TKI thế hệ một và thế hệ hai có sự khác biệt: gefitinib và erlotinib ức chế tín hiệu của thụ thể EGFR có hồi phục, trong khi afatinib ức chế không hồi phục cả 4 thụ thể của gia đình ErbB (gồm EGFR/ErbB1, HER2/ErbB2, ErbB3 và ErbB4)15-16. Trước đây, các thuốc EGFR TKI được xem là tương đồng, vì không có nghiên cứu đối đầu trực tiếp so sánh các thuốc TKI với nhau, mà chỉ so sánh thuốc TKI với hoá trị. Chính vì thế, các phân tích gộp đã được tiến hành để so sánh hiệu quả của erlotinib, gefitinib và afatinib, tuy nhiên không thể chỉ ra điểm khác biệt về hiệu quả, mà chỉ thấy sự khác biệt về các biến cố bất lợi.12-14
Chính vì sự khác biệt về cơ chế tác động của afatinib so với các TKI thế hệ thứ nhất và những điểm còn bất cập trong các thử nghiệm lâm sàng, nghiên cứu tiến cứu LUX-Lung 7 đã được tiến hành để đánh giá về hiệu quả và tính an toàn của TKI thế hệ thứ hai (afatinib) so với TKI thế hệ thứ nhất (gefitinib) trên bệnh nhân UTPKTBN có đột biến EGFR.
Đây là thử nghiệm lâm sàng pha IIB, đa trung tâm, ngẫu nhiên, nhãn mở, thực hiện trên 13 quốc gia.
| Tiêu chí nhận vào nghiên cứu |
|
| Tiêu chí loại trừ |
Đã hoá trị trước đó hoặc đã điều trị với thuốc EGFR TKI cho giai đoạn bệnh tiến triển
|
Bệnh nhân ung thư phổi carcinôm tuyến, giai đoạn IIIB-IV
Các kết cục đánh giá chính:
- Sống còn không bệnh tiến triển
- Thời gian đến khi thất bại điểu trị
- Sống còn toàn bộ
Afatinib 40mg uống 1 lần mỗi ngày
Gefitinib 250mg uống 1 lần mỗi ngày
Bệnh tiến triển hoặc biến cố bất lợi không dung nạp được
Bệnh tiến triển hoặc biến cố bất lợi không dung nạp được
Điều chỉnh liều afatinib theo hướng dẫn: khởi đầu với liều 40mg uống mỗi ngày. Sau 4 tuần điều trị, nếu bệnh nhân không có phát ban, tiêu chảy, viêm niêm mạc miệng, hoặc các biến cố bất lợi khác liên quan đến thuốc cao hơn độ 1, thì tăng liều thành 50mg mỗi ngày. Nếu bệnh nhân có biến cố bất lợi liên quan đến thuốc từ độ 3 trở lên, hoặc tiêu chảy độ 2 kéo dài từ 2 ngày trở lên, hoặc buồn nôn/nôn trong 7 ngày liên tiếp hoặc nhiều hơn, thì nên tạm ngừng thuốc trong dưới 14 ngày cho đến khi phục hồi về độ 1. Khi biến cố bất lợi hồi phục, giảm liều 10mg dần dần cho đến mức tối thiểu là 20mg. Ngừng điều trị nếu biến cố bất lợi không hồi phục về độ 1 trong vòng 14 ngày. Nhóm gefitinib có thể ngưng trị 14 ngày nhưng việc giảm liều không đề cập trong thông tin kê toa vì chỉ có một hàm lượng.
Đánh giá bướu: thực hiện CT-scan hoặc MRI sau 4 và 8 tuần điều trị, sau đó mỗi 8 tuần cho đến 64 tuần, và sau đó mỗi 12 tuần cho đến khi ngừng sử dụng thuốc nghiên cứu hoặc đến khi bệnh tiến triển.
Các kết cục phụ trong nghiên cứu:
- Tỷ lệ bệnh nhân có đáp ứng khách quan (bao gồm đáp ứng hoàn toàn và đáp ứng một phần)
- Thời gian đến khi đạt đáp ứng khách quan
- Tỷ lệ bệnh nhân đạt kiểm soát bệnh (bao gồm đáp ứng khách quan và bệnh ổn định)
- Thời gian kiểm soát bệnh
- Mức giảm kích thước bướu (mức giảm lớn nhất của tổng các đường kính lớn nhất của sang thương đích)
- Chất lượng cuộc sống liên quan đến sức khoẻ
Nghiên cứu từ 12/2011 đến 8/2013, thu nhận 319 bệnh nhân thỏa tiêu chí, với 160 bệnh nhân điều trị với afatinib và 159 bệnh nhân điều trị với gefitinib. Các đặc điểm ban đầu của dân số được trình bày trong bảng dưới đây cho thấy sự tương đồng giữa hai nhóm về nhiều đặc điểm, trừ giới tính (tỉ lệ bệnh nhân nữ ở nhóm afatinib ít hơn ở nhóm geftinib 10%).
| Đặc điểm dân số nghiên cứu ban đầu | ||
|---|---|---|
| Đặc điểm | Afatinib (n=160) | Gefitinib (n=159) |
| Giới tính | ||
| Nam | 43% | 33% |
| Nữ | 57% | 67% |
| Tuổi trung bình | 63 | 63 |
| Chủng tộc | ||
| Châu Á | 59% | 55% |
| Người Mỹ gốc Phi | 1% | 0 |
| Da trắng | 30% | 34% |
| Thiếu dữ liệu | 11% | 11% |
| Tình trạng hút thuốc | ||
| Không bao giờ hút thuốc | 66% | 67% |
| Người từng hút thuốc ít* | 13% | 12% |
| Người từng hút thuốc hay đang hút thuốc | 21% | 21% |
| Giai đoạn lâm sàng | ||
| IIIb | 5% | 2% |
| IV | 95% | 98% |
| Chỉ số thể trạng ECOG ban đầu | ||
| 0 | 32% | 30% |
| 1 | 68% | 70% |
| Loại đột biến EGFR | ||
| Leu858Arg | 42% | 42% |
| Leu858Arg đơn thuần | 42% | 41% |
| Leu858Arg + mất đoạn exon 19 | 0 | 1% |
| Mất đoạn exon 19 | 58% | 58% |
| Tình trạng di căn lúc tầm soát | ||
| Tuyến thượng thận | 8% | 10% |
| Xương | 50% | 46% |
| Não | 16% | 15% |
| Gan | 10% | 15% |
| Phổi cùng bên | 54% | 55% |
| Phổi đối bên | 41% | 46% |
| Vị trí khác | 63% | 65% |
| * hút ít hơn 15 gói/năm và đã ngưng hút 1 năm trước khi chẩn đoán | ||
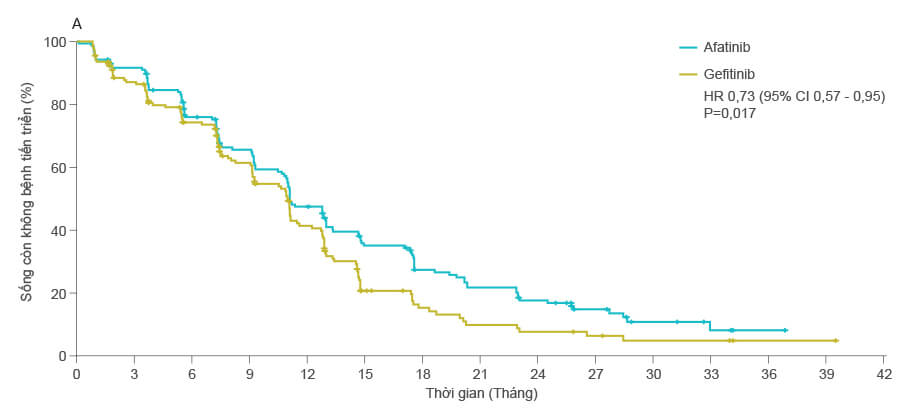
- Với đánh giá độc lập và đã được làm mù, kết quả cho thấy: thời gian sống còn không bệnh tiến triển trung vị ở nhóm điều trị với afatinib là 11 tháng (95% CI 10,6 – 12,9 tháng), dài hơn có ý nghĩa thống kê so với nhóm điều trị với gefitinib là 10,9 tháng (95% CI 9,1 –11,5 tháng).
- Kết quả được đánh giá bởi nghiên cứu viên cũng cho thấy kết quả tương tự (HR=0,78, p = 0,042)
- Nghiên cứu cũng đánh giá các kết quả về tỷ lệ sống còn không bệnh tiến triển tại thời điểm 12 tháng, 18 tháng và 24 tháng, và cho thấy tỷ lệ này ở nhóm điều trị với afatinib đều cao hơn so với nhóm điều trị gefitinib
Đánh giá sống còn không bệnh tiến triển bởi nhóm đánh giá độc lập
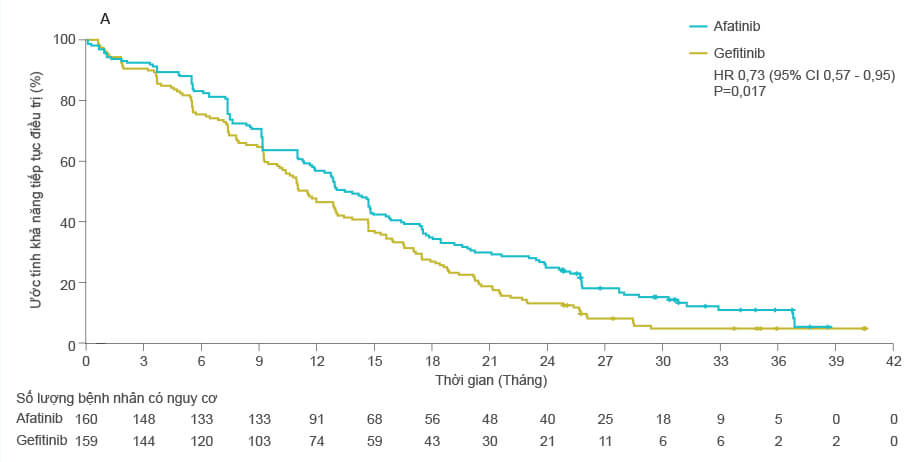
- Thời gian đến khi thất bại điều trị của nhóm điều trị với afatinib dài hơn có ý nghĩa thống kê so với nhóm điều trị gefitinib: 13,7 tháng so với 11,5 tháng, (HR=0,73; 95% CI 0,58 – 0,92; p=0,0073), giảm 27% nguy cơ thất bại điều trị.
Thời gian đến khi thất bại điều trị
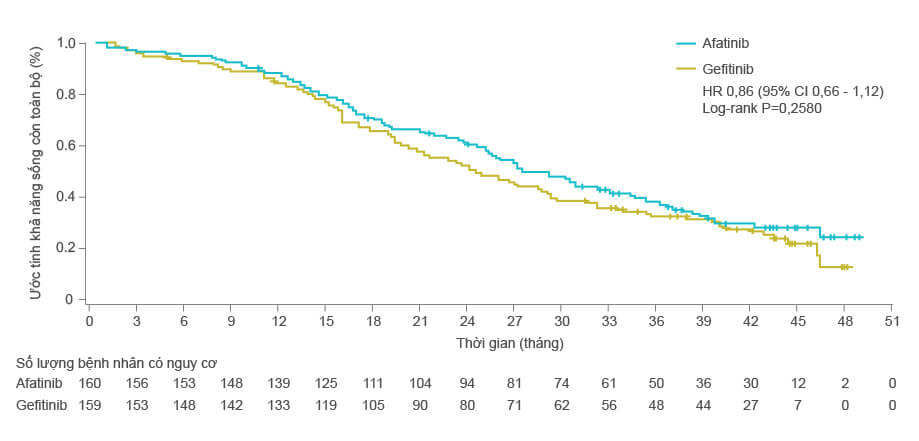
- LUX-Lung 7 là nghiên cứu đầu tiên so sánh hiệu quả trực tiếp giữa 2 loại TKI, và sau thời gian theo dõi trung vị 42,6 tháng, nghiên cứu đã ghi nhận trung vị sống còn toàn bộ của nhóm điều trị với afatinib là 27,9 tháng, dài hơn so với nhóm điều trị gefitinib là 24,5 tháng, tuy nhiên không có ý nghĩa thống kê (HR=0,86; 95% CI 0,66 – 1,12; p = 0,2580)
Biểu đồ Kaplan-Meier về sống còn toàn bộ giữa hai nhóm điều trị
- Trung vị sống còn toàn bộ khi điều trị với afatinib và gefitinib ở nhóm bệnh nhân có đột biến mất đoạn exon 19 tương ứng là 30,7 tháng và 26,4 tháng (HR=0,83; p=0,2841) và ở nhóm bệnh nhân có đột biến L858R tương ứng là 25 tháng và 21,2 tháng (HR=0,91; p=0,6585).
- Nghiên cứu ghi nhận 59,6% bệnh nhân trong nhóm điều trị với afatinib sống tối thiểu 24 tháng, và gần 50% bệnh nhân sống tối thiểu 30 tháng. Trong phân tích hậu kiểm trên bệnh nhân điều trị với EGFR TKI thế hệ 3 sau khi ngưng thuốc nghiên cứu, trung vị thời gian sống còn toàn bộ ở nhóm bệnh nhân dùng afatinib chưa đạt đến trung vị, so với nhóm dùng gefitinib là 46 tháng (HR=0,51; 95%CI 0,17-1,52, p=0,22)18.
- Nhóm điều trị với afatinib có tỉ lệ đáp ứng bướu khách quan đạt 70% cao hơn có ý nghĩa so với nhóm điều trị với gefitinib là 56% (p=0,0083).
- Thời gian đáp ứng trung vị đạt 10,1 tháng ở nhóm điều trị với afatinib, so với 8,4 tháng ở nhóm so sánh.
- Tương tự như vậy, trung vị thời gian kiểm soát bệnh của nhóm điều trị với afatinib và gefitinib lần lượt là 12,7 tháng so với 11,1 tháng.
- Các biến cố bất lợi từ độ 3 trở lên của nhóm điều trị với afatinib được ghi nhận là tiêu chảy (13%), phát ban da/ mụn (9%), mệt mỏi (6%).
- Ngược lại, các biến cố bất lợi từ độ 3 trở lên được ghi nhận của nhóm điều trị với gefitinib là tăng men gan ALT/AST (9%), phát ban/mụn (3%), và bệnh phổi mô kẽ (3%).
- Tỷ lệ ngừng điều trị cho biến cố bất lợi liên quan đến thuốc khá thấp ở cả hai nhóm.
Nghiên cứu LUX-Lung 7 là nghiên cứu đầu tiên so sánh một thuốc EGFR TKI thế hệ hai so với thế hệ một, trên bệnh nhân UTPKTBN có đột biến EGFR. Nghiên cứu LUX-Lung 7 tuy là một thử nghiệm lâm sàng pha IIB, nhưng với kích thước mẫu đủ lớn và đánh giá kết quả độc lập nên các kết quả từ nghiên cứu là đáng tin cậy. Nghiên cứu ghi nhận rằng, afatinib cải thiện có ý nghĩa thống kê về thời gian sống còn không bệnh tiến triển (PFS) (HR=0,73; p=0,0165), thời gian đến khi thất bại điều trị (TTF) (HR=0,73; p=0,0073) và tỉ lệ đáp ứng khách7,18 quan (ORR) (p=0,0083) so với gefitinib.
Các biến cố bất lợi liên quan đến afatinib đều dự đoán được, không ảnh hưởng chất lượng cuộc sống, và có thể xử trí được bằng cách điều chỉnh liều theo hướng dẫn.
1. Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004; 350:2129–39; 2. Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 2004; 304:1497–500; 3. Sharma SV, Bell DW, Settleman J, Haber DA. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7:169–81; 4. Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 2010; 362:2380–88; 5. Mitsudomi T, Morita S, Yatabe Y, et al. Gefi tinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010; 11:121–28; 6. Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361:947–57; 7. Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as fi rst-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13:239–46; 8. Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus emetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31:3327–34; 9. Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for fi rst-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15:213–22; 10. Wu YL, Zhou C, Liam CK, et al. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Ann Oncol 2015; 26:1883–39; 11. Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12:735–42; 12. Haaland B, Tan PS, de Castro G Jr, Lopes G. Meta-analysis of first-line therapies in advanced non-small-cell lung cancer harboring EGFRactivating mutations 8. J Thorac Oncol 2014; 9:805–11; 13. Haspinger ER, Agustoni F, Torri V, et al. Is there evidence for different effects among EGFR-TKIs? Systematic review and meta-analysis of EGFR tyrosine kinase inhibitors (TKIs) versus chemotherapy as fi rst-line treatment for patients harboring EGFR mutations. Crit Rev Oncol Hematol 2015; 94:213–27; 14. Popat S, Mok T, Yang JC, et al. Afatinib in the treatment of EGFR mutation-positive NSCLC--a network meta-analysis. Lung Cancer 2014; 85:230–38; 15. Li D, Ambrogio L, Shimamura T, et al. BIBW2992, an irreversible EGFR/HER2 inhibitor highly eff ective in preclinical lung cancer models. Oncogene 2008; 27:4702–11; 16. Solca F, Dahl G, Zoephel A, et al. Target binding properties and cellular activity of afatinib (BIBW 2992), an irreversible ErbB family blocker. J Pharmacol Exp Ther 2012; 343:342–50; 17. Park K, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016 May;17(5):577-89; 18. Paz-Ares L, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial Ann Oncol. 2017 Feb 1;28(2):270-77; 19. Miller VA, Hirsh V, Cadranel J et al. Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefitinib, or both, and one or two lines of chemotherapy (LUXLung 1): a phase 2b/3 randomised trial. Lancet Oncol 2012; 13: 528–38; 20. Schuler M, Yang JC, Park K et al. Afatinib beyond progression in patients with non-small-cell lung cancer following chemotherapy, erlotinib/gefitinib and afatinib: phase III randomized LUXLung 5 trial. Ann Oncol 2016; 27: 417–23; 21. Cappuzzo F, Morabito A, Normanno N et al. Efficacy and safety of rechallenge treatment with gefitinib in patients with advanced non-small cell lung cancer. Lung Cancer 2016; 99: 31–37.

Biên tập bởi MIMS. Các ý kiến được trình bày không nhất thiết của ban biên tập, nhà xuất bản hoặc nhà tài trợ. Ban biên tập, nhà xuất bản và nhà tài trợ không chịu trách nhiệm pháp lý cho bất kỳ tổn thất, mất mát nào có thể xảy ra.
© 2018 MIMS. All rights reserved. No part of this publication may be reproduced by any process in any language without the written permission of the publisher.

6 Phùng Khắc Khoan, Lầu 2, Phường Đa Kao, Quận 1, TP. HCM
ĐT: (84-8) 3829 7923
Fax: (84-8) 3822 1765
Email: enquiry.vn@mims.com

